

近期,南方医科大学药学院刘叔文教授团队在病毒来源淀粉样纤维促进脑损伤的致病机制与新靶标发现领域取得重要研究进展,成果发表于Acta Pharmaceutica Sinica B,论文题目为“Amyloid-like fibrils derived from β-sheets of gp120 contribute to the neuronal pathology of HIV-associated neurocognitive disorders”。该研究揭示了HIV包膜糖蛋白gp120降解的淀粉样多肽促进HIV相关认知障碍的神经病理新机制。
艾滋病等病毒性疾病引起原发或继发性脑损伤的发病率高,但存在机制证据不充分和诊疗不明确的特点。刘教授团队基于前期gp120可降解形成淀粉样多肽(GAPs, gp120-derived amyloid peptides)的发现(Cell Mol Immunol, 2024),建立了脑组织来源病毒淀粉样蛋白鉴定体系,在gp120转基因小鼠脑组织和临床HIV相关认知障碍患者脑脊液中,发现了具有神经毒性的GAPs。进一步机制研究发现,GAPs通过激活神经元上的趋化因子受体5(CCR5)及其下游通路发挥神经病理功能,已上市的抗艾滋病药物CCR5抑制剂Maraviroc可作为潜在的治疗策略,为HIV相关认知障碍的诊断和治疗药物开发提供新思路。
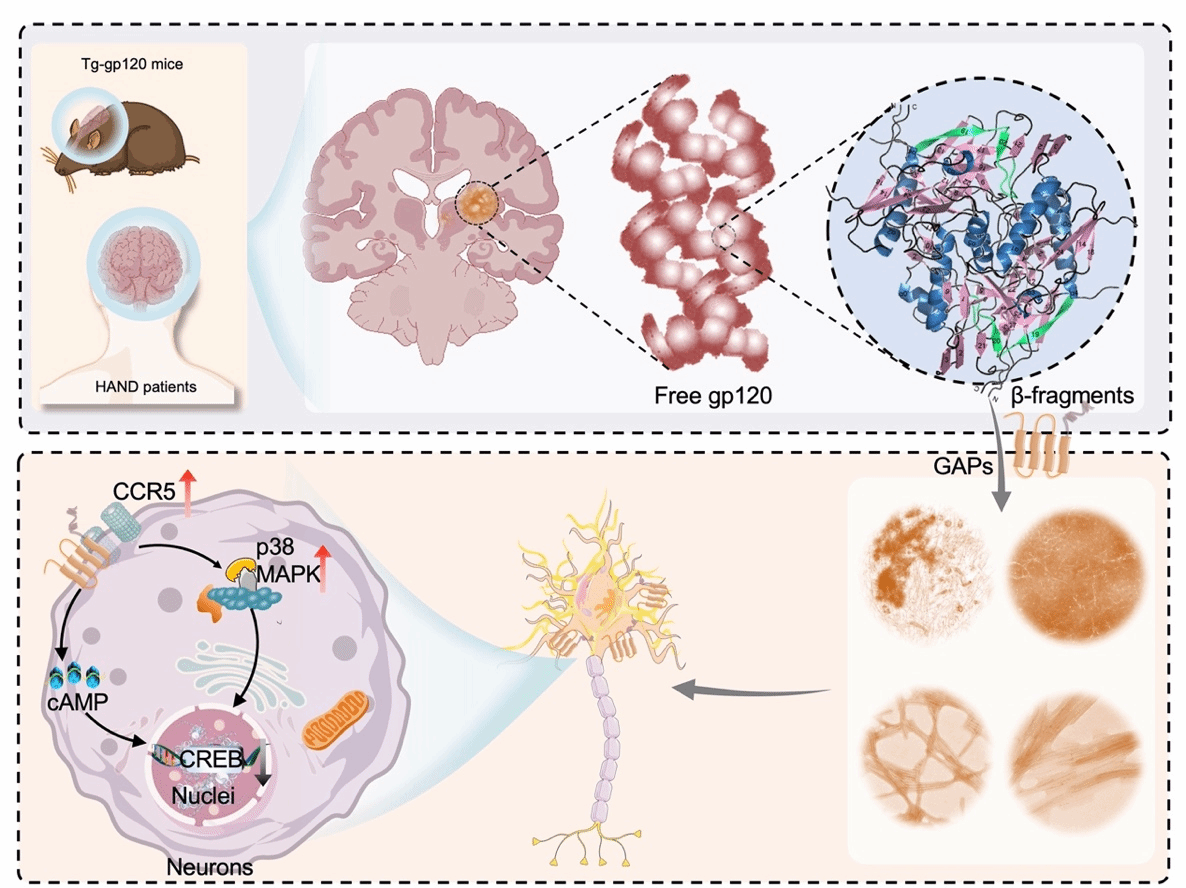
淀粉样蛋白的聚集是脑损伤的重要组织学标志,最初认为艾滋病相关认知障碍的发生也是来源于宿主细胞编码的蛋白,刘教授团队创新性地发现病毒来源淀粉样多肽可作为病毒致神经病变的新病因与早期诊疗靶标,助力新型抗病毒疫苗与小分子药物的研发,降低病毒相关认知障碍带来的社会经济与健康负担。
上述工作获得国家自然科学基金、广东省科技重大专项、广东省药品监督管理局科技创新项目等多项经费资助。博士后杨婵与博士生王如玉为论文共同第一作者,药学院刘叔文教授、谭穗懿教授、首都医科大学附属北京佑安医院张彤教授为论文的共同通讯作者。
原文链接:https://doi.org/10.1016/j.apsb.2025.02.024