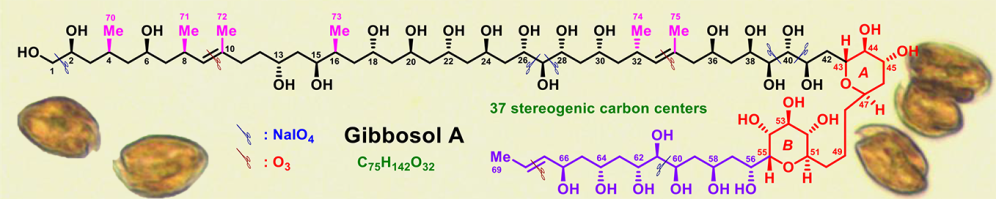
4月28日,我院吴军教授领衔的海洋药物研究团队,以“Research Article”在著名化学期刊德国应用化学(Angewandte Chemie International Edition)(IF:12.257)发表了题为“Determination of the Absolute Configuration of Super-Carbon-Chain Compounds by a Combined Chemical, Spectroscopic, and Computational Approach: Gibbosols A and B”的研究论文。该论文集成了化学降解、波谱解析、量子化学计算三种方法,采用高碘酸钠降解、臭氧裂解、基于耦合常数的构象分析、NOE效应、改良Mosher’s MTPA酯方法、DFT-NMR13C碳化学位移的量子化学计算(结合DP4+统计分析)、Kishi通用核磁共振数据库等技术手段成功地确立了中国南海甲藻(Amphidinium gibbosum)超级碳链化合物Gibbosols A和B的绝对立体化学。
海洋甲藻基因组庞大,其中绝大部分物种比人类基因组更大。它们能够产生分子量巨大、手性中心繁多的有机分子,例如岩沙海葵毒素和刺尾鱼毒素。除毒素外,海洋甲藻还产生超级碳链化合物(Super-Carbon-Chain Compounds),为海洋天然产物特有类型。该类化合物的结构骨架为一根高度氧化的从头彻尾碳碳链接而成的长碳链。其分子量巨大、手性中心繁多,核磁共振氢、碳信号严重重叠,结构鉴定难度巨大,尤其是绝对立体化学确立极具挑战性,目前尚无统一的方法学可以借鉴。
迄今,从海洋甲藻中共报道了50余个超级碳链化合物。其中仅Amphidinol3,Karlotoxin2和Ostreol B三个分子的绝对立体化学得以完全确立。它们分别含有25、28和24个碳手性中心。而Gibbosols A和B的分子中均含有37个碳手性中心,是本世纪以来绝对立体化学得以完全确立的分子量最大的超级碳链化合物。活性测试表明Gibbosol A能够显著地促进细菌脂多糖诱导的人脐静脉内皮细胞的血管细胞黏附分子-1的表达;反之,Gibbosol B却显著地抑制血管细胞黏附分子-1的表达。
吴军教授、暨南大学药学院申丽副教授、匈牙利德布勒森大学Tibor Kurtán教授为本文共同通讯作者。南方医科大学在站博士后黎婉珊和颜仁杰博士分别为第一、第二作者。该研究还受到了暨南大学生命科学技术学院石智教授的指导,并得到了国家自然科学基金委员会、广东省自然科学基金委员会和中国博士后基金会等部门的资助。
全文链接:https://www.onlinelibrary.wiley.com/doi/10.1002/anie.202004358