第五附属医院邱小忠教授团队在国际知名期刊发表新研究成果
近日,第五附属医院邱小忠教授及团队在ACS Nano上在线发表了题为“Ammonium Persulfate-Loaded Carboxylic Gelatin−Methacrylate Nanoparticles Promote Cardiac Repair by Activating Epicardial Epithelial−Mesenchymal Transition via Autophagy and the mTOR Pathway”的研究论文。第五附属医院博士后宋晨为论文的第一作者,邱小忠教授及其团队王乐禹教授为共同通讯作者。
过硫酸铵(APS)作为一种氧化剂,常在材料制备中用作化学催化剂,具有强的细胞毒性,南方医科大学邱小忠团队提出了一种“化毒物为药物”的材料生物学干预策略,同时采用APS作为纳米颗粒的化学催化剂和心肌梗死治疗药物,起到“一石二鸟”的作用。
心外膜细胞是一种多能性心脏祖细胞,在心脏发育和心脏重塑过程中起着重要的细胞来源作用。在心脏发育早期,心外膜细胞可以通过上皮-间充质转化(EMT),分化为平滑肌细胞、心脏成纤维细胞、内皮细胞、甚至可能分化为心肌细胞。而哺乳动物成年心外膜细胞在正常生理条件下通常是沉默状态,心梗后,它们可以重新启动胚胎期遗传程序,发生EMT分化成平滑肌细胞和肌成纤维细胞,不足以促进成人心脏的充分修复。通过增强内源性心外膜细胞EMT过程促进心梗修复,是一种有效的治疗途径。
基于此,邱小忠教授团队提出了一种“废物利用”策略,并提供了一个通过外源性刺激扩大内源性心外膜细胞EMT过程来促进心梗修复的方法。该团队制备了一种羧基化甲基丙烯酸酯明胶(carbox-GelMA)纳米颗粒(NP)来携带过硫酸铵(APS),形成NPs/APS。研究发现NPs/APS在体外可以诱导WT1+心外膜细胞EMT,转化为内皮样细胞,在体内心梗区注射NPs/APS后,其诱导的WT1+心外膜细胞EMT过程与自噬和mTOR通路有关。诱导内源性心外膜细胞EMT是梗死区持续产生新生血管的有效方法,此研究为心梗修复提供了新的理论基础和材料储备。

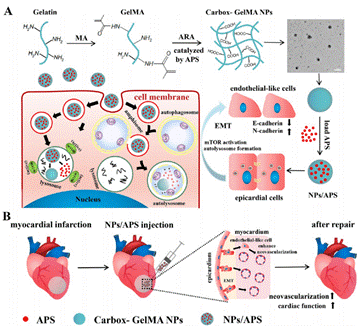
图1. (A) NPs/APS的制备及其在体外诱导WT1+心外膜细胞EMT的机制。(B) NPs/APS可以促进梗死区血管新生从而促进心梗修复。
