

10月17日,我院赵鹏教授在Advanced Materials上(IF: 32.086)在线发表题为“Synergistic Reinforcing of Immunogenic Cell Death and Transforming Tumor-Associated Macrophages Via a Multifunctional Cascade Bioreactor for Optimizing Cancer Immunotherapy”的研究论文。南方医院许乙凯教授,华南理工大学陶佳副教授为本文的共同通讯作者。
免疫检查点阻断(ICBs)已经显示出治疗多种癌症的巨大潜力;然而,只有少数患者(小于15%)可以从ICBs疗法中受益,其他患者的治疗效果受到低免疫原性的“冷”肿瘤特性和T细胞浸润的限制。肿瘤的免疫原性细胞死亡(ICD)已被证明是提高肿瘤细胞免疫原性的有效工具。从经历ICD的肿瘤细胞中充分释放损伤相关分子模式(DAMPs)对于提高免疫治疗效率至关重要。除了肿瘤细胞的低免疫原性,被抵消的先天免疫系统也是ICBs治疗效果差的原因。肿瘤中的抑制性免疫细胞,包括肿瘤相关巨噬细胞(TAMs)和调节性T细胞(Tregs),总是会导致免疫治疗失败,因为它们限制了T细胞浸润并耗尽细胞毒性T淋巴细胞。
针对此问题,该研究提出了一种改进的免疫疗法,使用CaO2@CuS-MnO2@HA纳米颗粒(CCMH)双向增强ICD和重置TAM,CCMH包括修饰有透明质酸(HA)的CaO2纳米颗粒和超小CuS-MnO2纳米颗粒。肿瘤细胞摄取CCMH后,CaO2纳米颗粒与H2O反应,在酸性肿瘤微环境中产生大量Ca2+和O2。此外,CuS发挥由近红外-II (NIR-II)辐射(1064 nm)触发的光动力治疗(PDT)和光热治疗(PTT)效应。通过光疗法不可逆地破坏线粒体功能促进Ca2+超载,并且通过增加O2和MnO2消除谷胱甘肽会增强PDT产生1O2。
通过PDT触发的Ca2+超载和CaO2增强的PDT的ICD的双向增强使DAMPs充分释放。同时,逃逸的氧化损伤线粒体DNA也能使TAM向M1表型复位。当与抗程序性死亡配体1 (aPD-L1)介导的ICB结合时,CCMH为针对原发性和远处肿瘤的免疫治疗提供了有吸引力的选择。
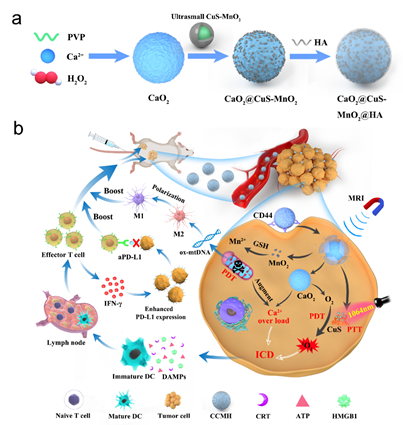
图1. CCMH联合NIR-II光疗用于优化癌症免疫治疗示意图。
全文链接: https://onlinelibrary.wiley.com/doi/10.1002/adma.202207593