

近日,我院姚新刚副教授作为第一作者在国际学术刊物Journal of Extracellular Vesicles(IF=14.979)发表了题为“Engineered extracellular vesicles as versatile ribonucleoprotein delivery vehicles for efficient and safe CRISPR genome editing”的研究论文。该文主要开发了一种外泌体囊泡递送系统,进行安全高效的CRISPR基因编辑,具有显著的临床意义。
CRISPR介导的基因编辑对基因治疗带来了巨大的前景,目前已有多项基于CRISPR的临床试验进行。然而目前将CRISPR递送到相应的细胞甚至体内应用依然缺乏安全有效的手段,在细胞层面目前主要依赖于电转手段将CRISPR系统运送到细胞中,操作上比较复杂。而基于慢病毒和AAV的CRISPR递送体系不仅会造成免疫原性,而且往往容易整合到基因组中长期表达,引发不良后果。近年来,为了降低CRISPR系统的脱靶效应和免疫原性,逐渐认为直接将CRISPR蛋白和sgRNA构成的RNP复合物直接递送进细胞实现短期表达可以降低脱靶效应和免疫原性。为了解决该问题,基于外泌体系统的递送体系受到了广泛关注,目前开发了基于CD63-GFP/Cas9-GFP-binding antibody,和FKBP12/FRB系统。然而,这两种系统的细胞编辑效率较低。
对此姚新刚副教授与维克森林大学Baisong Lu合作,分别对慢病毒系统进行了改造,同时也设计出了一种基于RNA配体com和配体结合蛋白Com的富集系统用于解决该问题。作者将com序列插入sgRNA序列中,同时将Com融合于CD63蛋白的N端和C端。由于外泌体中富含CD63蛋白,因此Com-CD63-Com在外泌体中高表达,同时Com-CD63-Com通过与sgRNA-com结合达到富集的效果。作者构建了多种RNPs验证其效果,在细胞水平发现其富集RNPs(spCas9, saCas9以及ABE系统)效率可以达到10倍以上,同时其脱靶效率显著降低。该系统不仅可以单独包装,也可以将多个RNPs进行共包装,而且发现共包装外泌体系统优于单独的外泌体相加。作者也在体内水平验证了该系统的基因编辑效率,在del52hDMD/mdx小鼠模型中,注射包装了DMD exon 53 RNP的外泌体,通过confocal也观察到了肌肉dystrophin蛋白的表达。
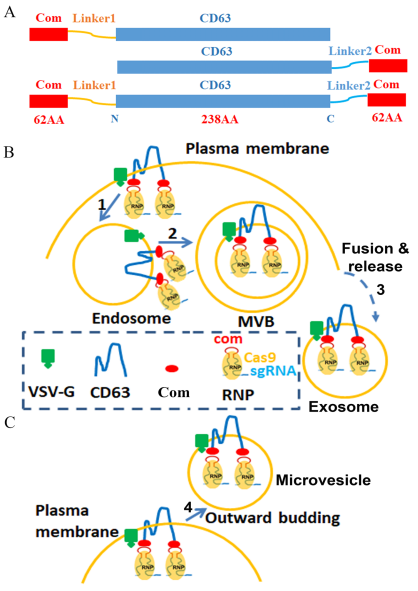
该研究提供了一种免疫原性低于病毒系统的RNPs递送系统,且其效率显著高于同类型的外泌体系统,局部注射也具有显著的基因编辑效果。基于外泌体独特的免疫原性和归巢特性,以及穿过血脑屏障等特点,该系统对于全身性基因治疗中具有广阔的前景。
原文链接: