BMC Med︱赵存友课题组揭示等位基因特异性羟甲基化转换参与重性精神病表型变异的机制
2023年12月12日,《BMC Medicine》期刊发表题为Transition of allele-specific DNA hydroxymethylation at regulatory loci is associated with phenotypic variation in monozygotic twins discordant for psychiatric disorders的研究论文。该研究由粤港澳大湾区脑科学与类脑研究中心的赵存友课题组完成,揭示了等位基因特异性羟甲基化转换参与重性精神病表型变异的机制。

精神分裂症(SCZ)和双相情感障碍(BPD)是复杂的遗传性重性精神疾病。尽管通过遗传学手段发现了多个疾病相关易感基因,然而该病的同卵双生子对共病率约为50%等现象表明,除遗传因素外,环境因素尤其表观遗传因素在精神分裂症发生发展中起着重要作用。近年来,赵存友教授团队通过对表型不一致同卵双生子的表观遗传特征系统检测,发现了DNA甲基化(Mol Psychiatry, 2021a,PMID: 33963283)、长链非编码RNA(Mol Psychiatry, 2021b,PMID: 32015466)和miRNA(Science Advances ,2022, PMID:35984881)水平等表观遗传修饰与SCZ或BPD患病风险存在显著关联。5-羟甲基胞嘧啶(5-Hydroxymethylcytosine, 5hmC)是DNA去甲基化过程的中间产物,并可通过影响染色质构像等参与基因转录调控。近年来发现人体存在多种遗传变异相关的等位基因不平衡现象,例如DNA甲基化、组蛋白修饰或开放染色质构像的等位基因不平衡,表现出疾病表型变异相关的动态变化,这为研究遗传与表观遗传因素相互作用参与表型变异提供了契机。而遗传变异对DNA羟甲基化组及其二者关系对重性精神疾病表型的影响,尚未见相关研究。
该研究通过对同卵双生子对(包括单患精神病、双患精神病以及健康同卵双生子对)外周血DNA的羟甲基化组和基因组的检测和整合分析,鉴定了数千个受遗传变异调控的Allele-specific hydroxymethylation (AShM)位点。这些位点表现出与表型变异相关的AShM转换,并可通过影响组蛋白修饰、染色质状态、转录因子(TFs)的结合等参与基因表达调控,从而影响个体患病风险。研究还验证了疾病相关AShM转换位点rs4558409(G/T。健康组中G等位基因表现为高羟甲基化,转换到疾病组中为T等位基因的高羟甲基化)的调控机制。该位点T等位基因有助于转录激活因子 POU3F2的结合;疾病组中观察到的T等位基因的高羟甲基化可弱化POU3F2在rs4558409位点的结合,从而减弱对PLLP的激活,这与BPD或SCZ中观察到的PLLP表达下调相一致。进一步通过Cas9/sgRNA编辑技术破坏rs4558409周围序列,可显著增加SK-N-SH细胞中PLLP mRNA和蛋白表达的水平,并促进神经发育和囊泡分泌。此项研究为鉴定疾病相关风险变异提供了强有力的研究策略,并有助于我们理解遗传和表观遗传因素相互作用介导SCZ或BPD易感性的机制。
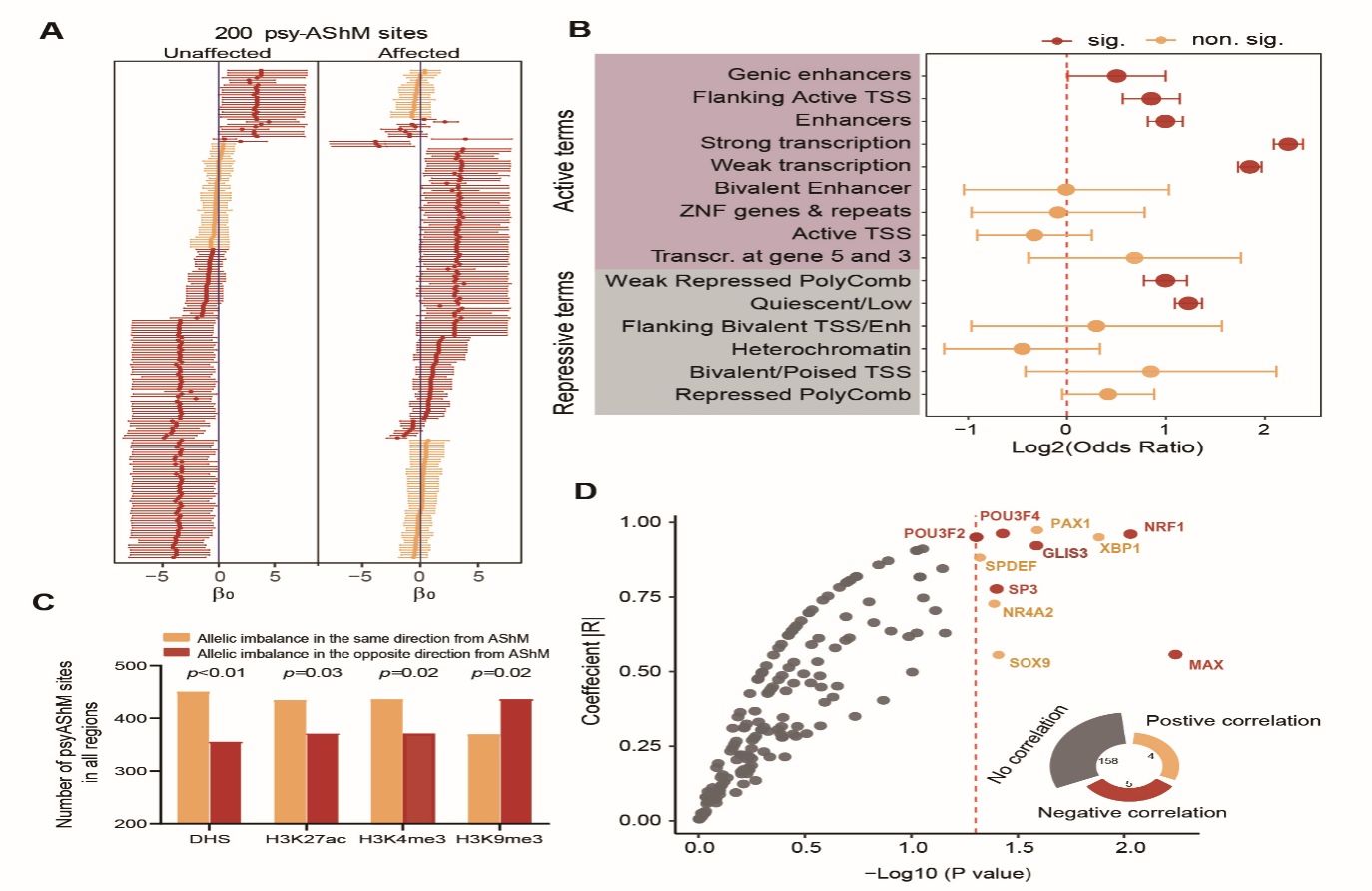
图2
赵存友教授和江南大学无锡医学院陈建欢教授为该研究论文的共同通讯作者,南方医科大学基础医学院遗传学专业硕士叶俊平和黄展旺为本文并列第一作者。该研究得到了科技部、国家自然科学基金委和广东省科技厅的资助。
原文链接:https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-023-03177-y


