

癌症免疫治疗发展迅速,成为癌症研究最热门的领域之一。虽然PD-1/PD-L1单抗药物在临床上取得巨大成功,但其单药治疗应答率低(~20%)。因此,设计能作用于双/多靶点的药物,例如双靶向“PD-1/PD-L1+其他靶点”的双功能分子(如双特异性抗体药物),成了癌症免疫药物研发的新热点。目前已有多个基于PD-1/PD-L1的双抗药物进入临床试验,如默克公司的M7824及恒瑞医药的SHR-1701(PD-L1/TGF-β双抗)、康宁杰瑞的KN046(PD-1/CTLA-4双抗)、康方生物的AK112(PD-1/VEGF双抗)等。但抗体药物存在对肿瘤组织渗透性低、不能口服、免疫原性、生产成本高等问题,而小分子则基本可以克服上述问题。
CXCL12是肿瘤发生发展中的关键调控因子,可调控肿瘤侵袭及转移能力,在肿瘤免疫逃逸中起重要作用,可导致PD-1/PD-L1抗体治疗耐药。CXCL12和PD-L1在肿瘤微环境中高度表达。因此,研发小分子癌症免疫药物,特别是双靶向“PD-1/PD-L1+ CXCL12/CXCR4”的双功能小分子,有望弥补抗体药物的不足,拓展癌症免疫治疗的应用。为此,南方医科大学药学院陈建军教授、刘叔文教授团队,围绕抑制PD-L1与CXCL12靶点作为癌症双免疫疗法进行了研究。相关成果以题为“Bifunctional Small Molecules Targeting PD-L1/CXCL12 as Dual Immunotherapy for Cancer Treatment”的文章发表在Nature子刊Signal Transduction and Targeted Therapy上 [STTT 2023 Mar 1;8(1):91; IF 38.104]。南方医科大学程斌斌博士、王巍博士为论文的共同第一作者,陈建军教授、刘叔文教授为共同通讯作者。
首先,陈建军教授团队采取基于PD-L1&CXCL12药效团融合的设计策略,对设计合成的一系列双功能PD-L1&CXCL12小分子化合物进行了活性评价,发现了其中一个化合物CP21具有优异的抑制PD-1/PD-L1以及CXCL12的活性。在细胞层面,CP21具有显著的促进干扰素释放,增强免疫细胞杀伤肿瘤细胞能力,同时CP21能抑制CXCL12介导的Ca2+内流,并剂量依赖性地抑制了CXCL12介导的细胞迁移。
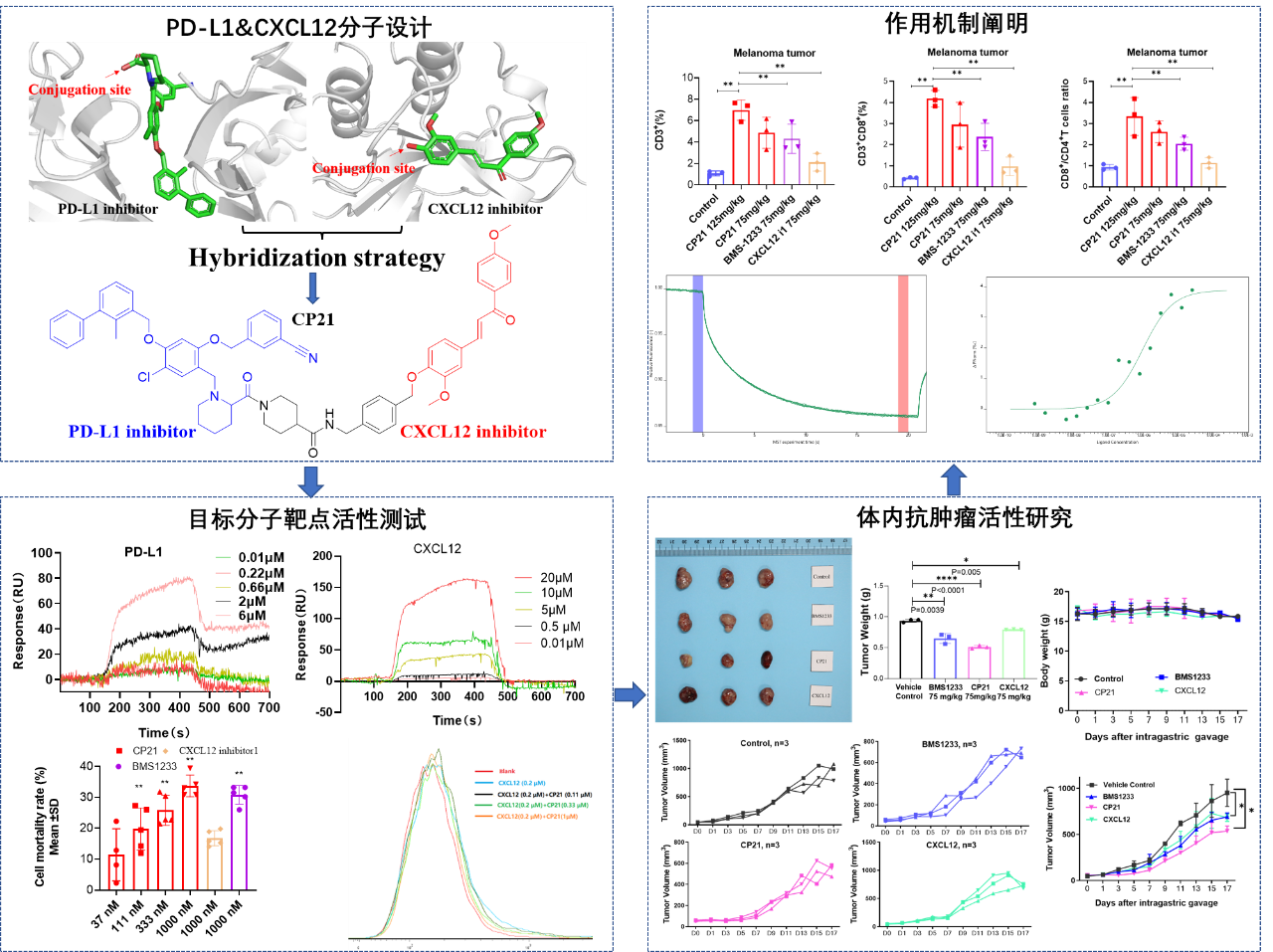
此外,CP21具有良好的体内抗肿瘤活性,在小鼠黑色素瘤以及小鼠结肠癌模型中,PD-L1&CXCL12双功能抑制剂CP21治疗后,能够明显减少肿瘤的生长。机制研究表明,PD-L1&CXCL12双功能抑制剂CP21通过增强小鼠体内细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)在肿瘤细胞的浸润,激活肿瘤免疫微环境发挥抗癌作用。总之,本研究创新性的提出 PD-L1&CXCL12 双功能小分子作为癌症的双免疫联合疗法,通过PD-L1以及CXCL12互补而不重叠的途径解除肿瘤免疫抑制,有望解决 PD-1/PD-L1 抑制剂应答率低以及联合用药存在的问题,弥补 PD-1/PD-L1 抗体药物的不足,为癌症双免疫疗法提供新策略、新先导化合物和科学依据。
全文链接:https://pubmed.ncbi.nlm.nih.gov/36854661/