

单纯疱疹病毒(HSV)作为一种嗜神经病毒,主要分为1型(HSV1)和2型(HSV2)。目前的核苷类抗HSV药物如阿昔洛韦和伐昔洛韦等只能用于症状的控制和感染的复发。HSV-1可通过感染部位逆向传播至三叉神经节,并在此建立病毒潜伏库且终生存在。因此没有任何治疗策略可以清除潜伏的病毒。成簇的规则间隔短回文重复序列(CRISPR)相关的核酸内切酶9 (Cas9) 被用于精确的基因编辑,它具有基因编辑效率高、脱靶效应低等优点,为疾病的治疗带来巨大希望。然而,CRISPR/Cas9治疗应用的主要挑战之一是将Cas9蛋白安全、有效和有针对性地递送至靶向部位。目前已有研究将CRISPR靶向HSV基因组来消除HSV感染,这些研究在支持CRISPR-Cas9治疗HSV的潜在临床效用的同时,也存在递送策略效率低下,易于被体内免疫系统清除以及缺乏神经靶向能力等缺点。EVs近年来已经成为了CRISPR/Cas9核糖核蛋白(RNPs)的一个有前途的递送平台,与其他递送载体如脂质体等相比,它们在安全性方面独具优势。然而,如何提高Cas9-RNP在EVs中富集的效率和安全性仍然是一个挑战。
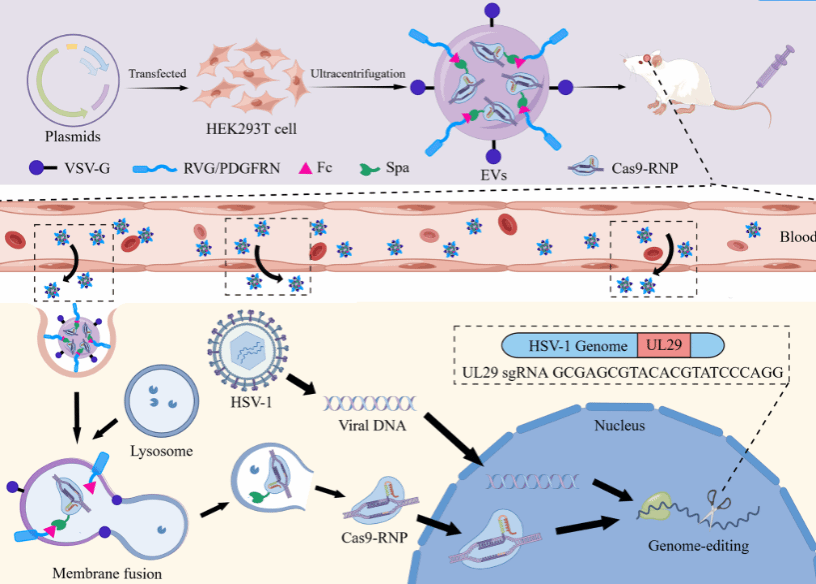
基于前期基于Com/com系统的研究基础上(JEV, 2021),课题组创新性地设计了Fc/Spa相互作用系统, 拟利用其高效的亲和力将Cas9-RNP富集在细胞外囊泡中。同时通过Cre-loxP系统发现,PTGFRN-∆687具有显著的富集优势。最终将人Fc结构域融合到PTGFRN-∆687的胞内结构域并锚定在细胞外囊泡中,携带有Spa-tag的spCas9分子即通过Fc/Spa相互作用系统显著富集在细胞外囊泡中。研究结果表明,由于Fc和Spa之间强有力的相互作用,这种方法使EVs内的货物量增加了近两倍。另外,装载有靶向HSV1基因组的spCas9 RNP的EVs在体外和体内都表现出对病毒复制的显著抑制。在神经元靶向肽RVG修饰后,EVs在神经组织中的体内含量显著增加,这有助于清除神经组织中的HSV1病毒,并表现出较低的脱靶效率。这些发现为基于EV的SpCas9高效递送建立了一个强大的平台,为HSV1感染和其他神经系统疾病提供了潜在的治疗优势。
该研究工作得到了广东省自然科学基金和国家自然科学基金的大力支持。南方医科大学药学院姚新刚副教授和刘叔文教授为通讯作者,南方医科大学硕士生万源达为本文的第一作者。
全文链接:https://doi.org/10.1016/j.apsb.2023.10.004.