

近日,我院周东方教授团队在国际著名学术期刊Advanced Materials(DOI: 10.1002/adma.202170304)(IF:30.849)在线发表题为“Engineering Endogenous Tumor-Associated Macrophage-Targeted Biomimetic Nano-RBC to Reprogram Tumor Immunosuppressive Microenvironment for Enhanced Chemo-Immunotherapy”的研究论文,并当选为封面文章(Inside Front Cover)。
由肿瘤细胞、基质细胞和浸润的免疫细胞构成的高度复杂的肿瘤免疫抑制微环境(TIME)是导致肿瘤化疗和免疫治疗的治疗效率较低的重要原因。肿瘤相关巨噬细胞(TAMs)是最丰富的肿瘤浸润白细胞之一,特别是M2型TAMs在促进肿瘤生长、血管新生、肿瘤转移及免疫逃逸等方面发挥重要作用。因此通过清除或极化M2型肿瘤相关巨噬细胞有望重塑肿瘤免疫抑制微环境来提高肿瘤治疗的效果。但是由于巨噬细胞在体内广泛分布和在先天免疫中的关键作用,生物安全性是基于TAMs治疗的主要障碍。因此,如何实现M2型TAMs的特异性靶向治疗一直是研究的瓶颈难题。
我院周东方教授团队设计合成了一种血红蛋白-聚(ε-己内酯)(Hb-PCL)共轭聚合物并自组装成仿生纳米红细胞递送系统(V(Hb))。利用血红蛋白能够与内源性血浆结合珠蛋白(Hp)自发结合并通过CD163表面受体特异性靶向M2型巨噬细胞的特点,使该递送系统V(Hb)@DOX能够实现对M2型TAMs的内源特异性靶向杀伤,并且血红蛋白的携氧功能能够改善肿瘤的乏氧微环境,从而对TIME进行重塑,实现高效的癌症化疗-免疫治疗联合治疗。在原位小鼠乳腺癌(4T1)转移模型还是皮下小鼠结肠癌(CT26)的术后复发模型中,V(Hb)@DOX均能够显著减少肿瘤内TAMs和相关免疫抑制因子,增加T细胞浸润,有效地抑制了肿瘤转移和复发,并极大地降低了小分子药物的相关毒性。
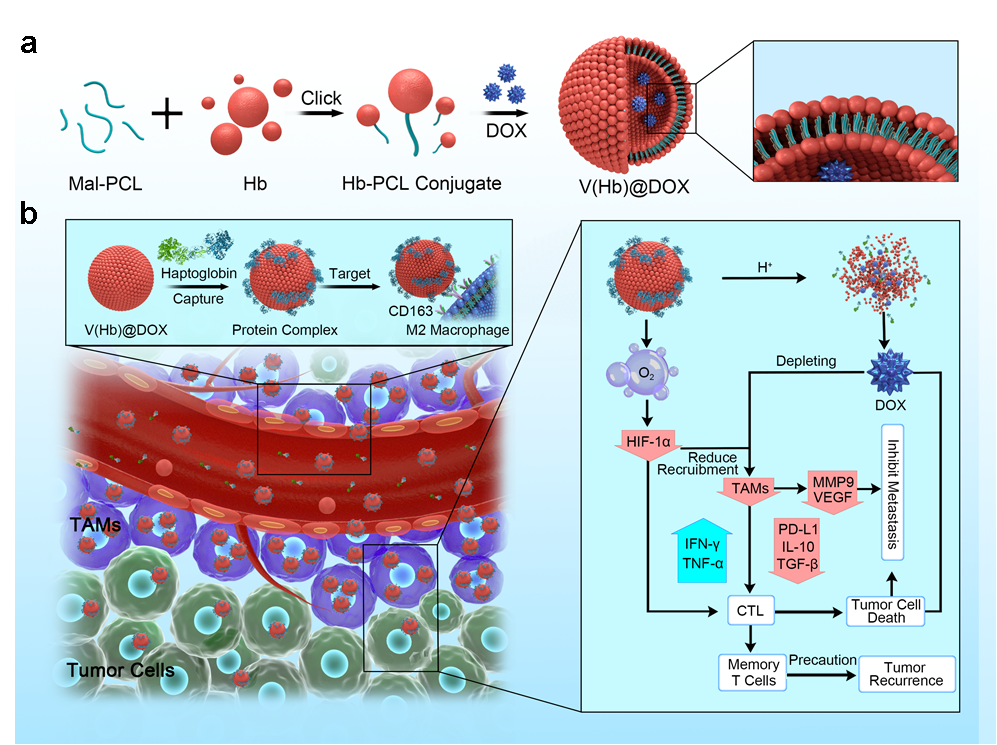
该研究提供了一种内源特异性靶向TAMs的仿生纳米红细胞递送系统,能够安全高效的靶向递送化疗药物与氧气,协同重塑TIME,在癌症TAMs靶向免疫治疗中的应用前景广阔。周东方教授为本文的最后通讯作者,东北师范大学黄宇彬教授为共同通讯作者,南方医科大学在站博士后王玉鹏为第一作者,该论文得到了国家自然科学基金委等项目支持。

全文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202103497
封面链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202170304