

近日,Nucleic Acids Research(IF:19.16, 1区)在线发表了题为“Phase-separated DropCRISPRa platform for efficient gene activation in mammalian cells and mice”的研究论文。南方医科大学深圳医院肾内科博士后马淑凤为本文第一作者,基础医学院荣知立教授、林瑛副教授和深圳医院肾内科郭啸华教授为共同通讯作者。
CRISPR基因编辑技术是近年发展较快的一项重要生物学技术,可用于基因切割、基因整合、基因激活和基因抑制等。其中,CRISPR基因激活系统(CRISPRa, CRISPR activation)通过将转录激活因子与Cas酶活缺失突变体蛋白结合,从而靶向激活基因转录,是一种不造成基因组一级序列改变而精准诱导内源性基因表达的技术。但当前基因激活系统存在普适性局限和效能不稳定的问题,因此,需要开发更普适和高效的激活系统。
液-液相分离(LLPS,liquid-liquid phase separation)是细胞内的无膜细胞器,参与多种生理病理过程,且近期发现LLPS是激活基因转录的关键新机制。该研究团队结合LLPS和CRISPRa系统,开发出DropCRISPRa基因激活系统,包含CRISPR-SunTag组件和可形成相分离的FETIDR-VP64组件,其中FETIDR是FET 家族蛋白(FUS 或 TAF15)的 N 端固有无序区域 (IDR)。此系统一方面通过CRISPR-SunTag中多个重复的GCN4与FETIDR-VP64中的scFv-GCN4特异结合,完成一级VP64富集到启动子区,同时也利用了IDR间相互作用进行了二级富集,使启动子区富集更多的VP64,促进转录起始,另一方面,IDR间相互作用会发生相分离,招募内源性转录激活因子,增强转录延伸速率;该研究团队也利用缺陷型IDR-FUS9Y>S和异常型IDR-FUSG156E相分离的突变体证实了具有适当流动性的相分离才能有效的促进基因激活;此外,DropCRISPRa 系统与广泛的 CRISPR-Cas 蛋白和 转录激活因子兼容,包括 dLbCas12a、dAsCas12a、dSpCas9 和微型 dUnCas12f1,以及 VP64、P65 和 VPR等激活因子;最后,DropCRISPRa 系统也可以在成年小鼠肝脏内激活内源性目标基因。
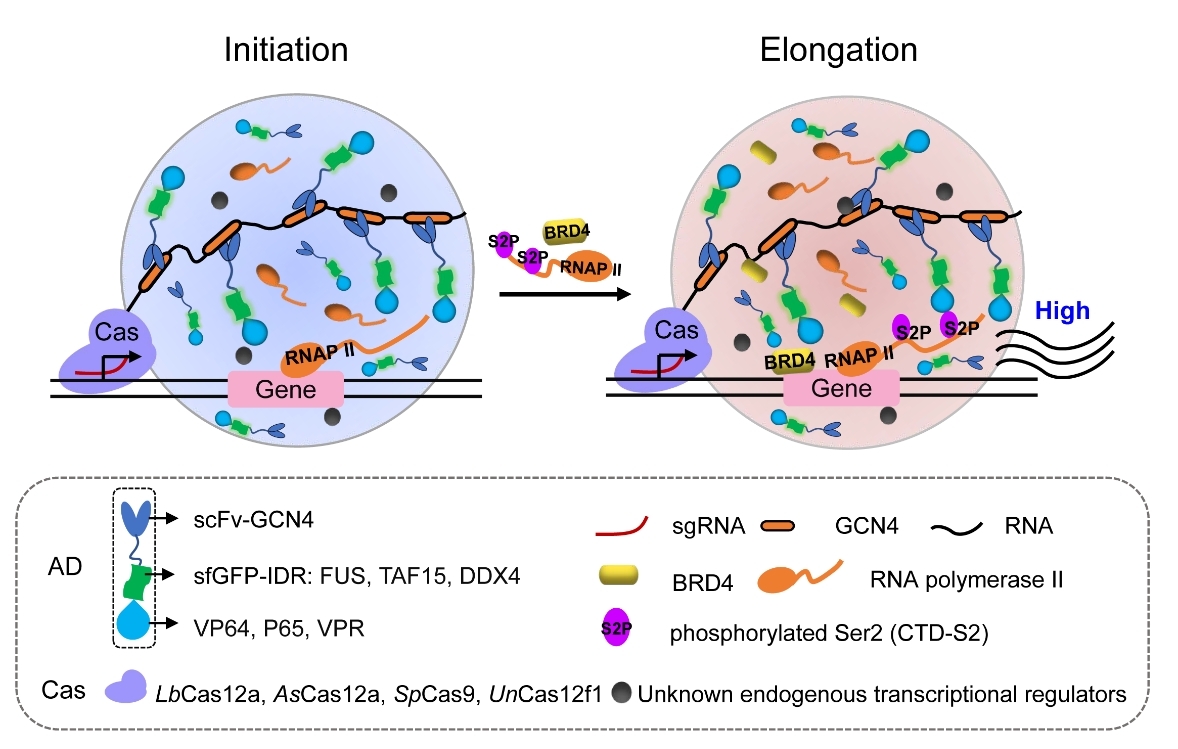
附图. DropCRISPRa系统激活基因转录原理示意图
DropCRISPRa 系统是结合LLPS和CRISPRa构建的人工相分离基因激活系统,该系统是当前最强的基因激活系统之一,具有更好的普适性,可以更稳定高效的激活各种内源性基因的表达,这项研究为基础研究和潜在基因治疗方案提供了激活基因表达的重要工具。
全文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad301/7137450?login=true