

近日,我校基础医学院肿瘤研究所段晓品教授团队在国际知名期刊《Science Advances》发表题为“Morphology– and adhesion–dual biomimetic nanovaccine boosts antigen cross-presentation through subcellular transport regulation”的研究论文。该研究创新性地开发出一种兼具形态仿生与生物黏附特性的纳米疫苗,通过对抗原亚细胞层面的转运进行精准调控,提高抗原交叉递呈效率,为肿瘤原位疫苗疗法提供了全新策略。
肿瘤免疫治疗是当前癌症治疗的前沿方向,其中原位肿瘤疫苗通过激发机体对肿瘤自身抗原的免疫应答,具有精准靶向、副作用小等优势。然而,原位释放的肿瘤源性抗原易被快速降解和清除,严重制约了抗原呈递效率和免疫治疗效果。
针对这一关键瓶颈,科研团队仿生设计出一种金纳米苍耳-聚多巴胺纳米疫苗。该纳米疫苗巧妙融合了两种生物特性:一方面模拟苍耳表面的尖刺结构,大幅增加表面积以增强抗原捕获能力;另一方面借鉴贻贝足蛋白的黏附特性,通过聚多巴胺涂层与肿瘤抗原形成稳定结合,有效解决了传统纳米载体抗原吸附不稳定、易脱落的问题。同时通过调控抗原亚细胞转运过程,促进其向内质网-高尔基体的转运,从而显著提高交叉呈递效率,为解决原位肿瘤疫苗的关键技术难题提供了新思路。
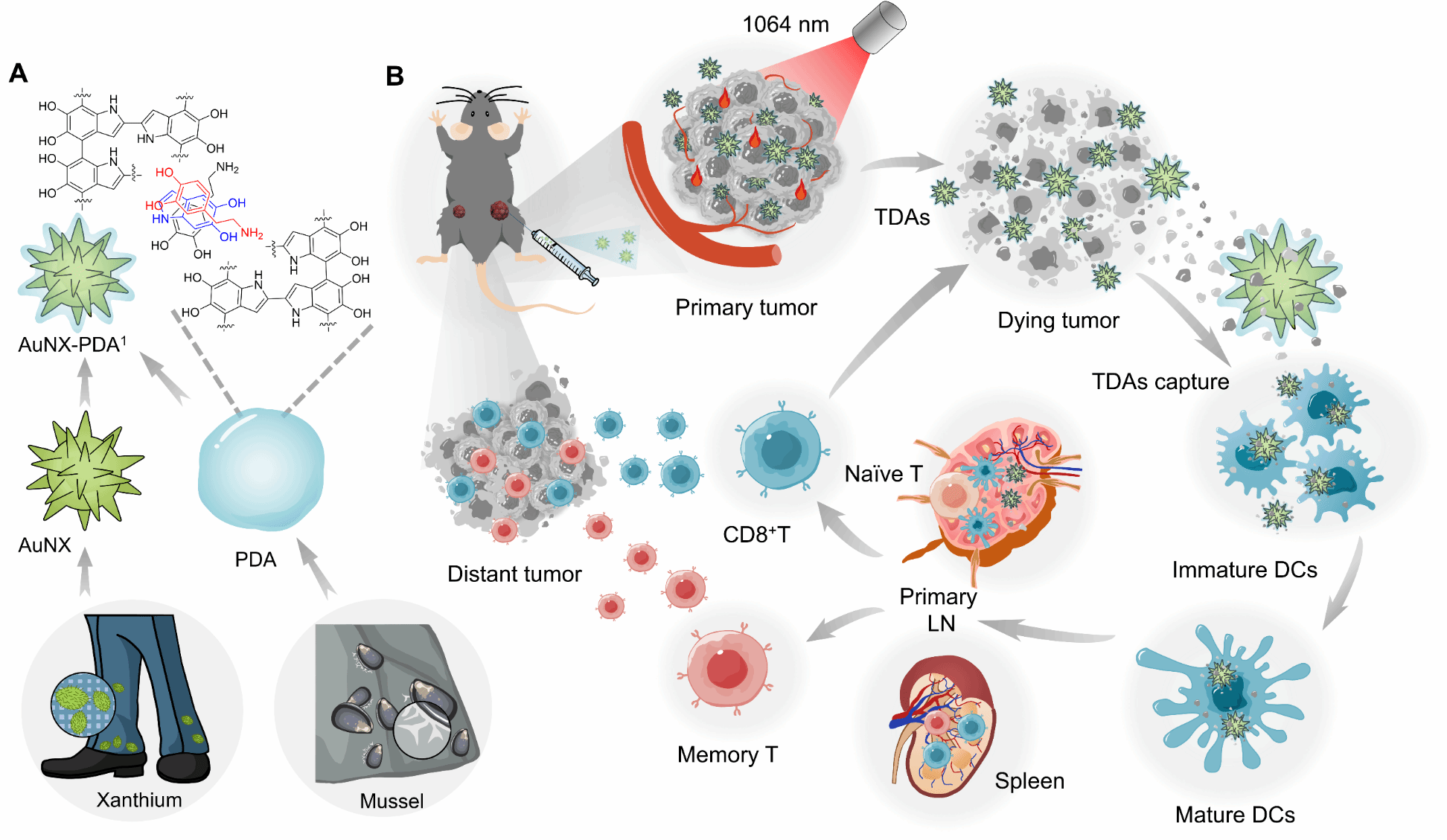
附图 双仿生疫苗的制备及其疫苗效应示意图
本项研究得到国家自然科学基金项目和广东省自然科学基金项目等资助。南方医科大学珠江医院博士王振雨,基础医学院博士周慧敏和苏倩意为该论文共同第一作者。南方医科大学基础医学院肿瘤研究所段晓品教授和珠江医院肖计生教授为通讯作者。