

2021年10月15日,基础医学院白晓春、宋千成团队在Nature Communications(影响因子14.919)上,发表了题为“Damaged Brain Accelerates Bone Healing by Releasing Small Extracellular Vesicles that Target Osteoprogenitors”论文。白晓春教授和宋千成副教授为共同通讯作者,博士后夏巍、博士生谢菁和蔡志清为共同第一作者。
该研究发现:颅脑损伤(Traumatic brain injury,TBI)后血浆中的小细胞外囊泡(small extracellular vesicles, sEVs)的含量升高,并且具有促成骨的功能。TBI 后血浆sEVs中富含 miR-328a-3p和 miR-150-5p,而这两种miRNA都具有促进成骨的功能。骨延迟愈合、骨不连是临床上骨折致残的最主要原因。大约10%的骨折患者由于骨再生不足导致成为骨不连。目前临床上还没有治疗骨愈合延迟或骨不连的药物。研究团队将上述miRNA电转至sEVs,并包埋至水凝胶,将其应用于骨缺损动物模型,结果显示可加快骨修复,特别是对于不可愈合的颅骨缺损有显著的治疗效果,提示上述分子具有治疗骨延迟愈合和骨不连的潜力。
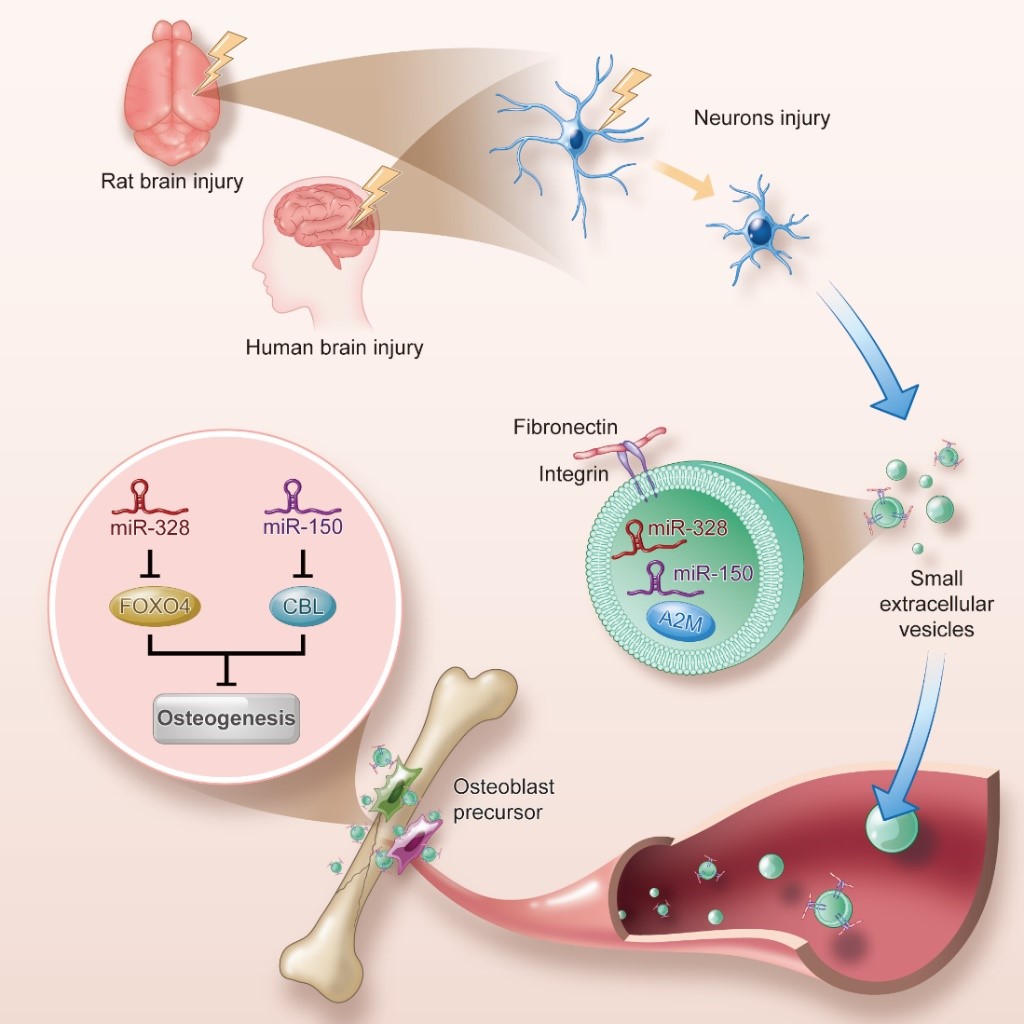
Figure 1. Scheme of the mode of damaged brain accelerates bone healing
促骨愈合的sEVs从何而来?蛋白组学分析结果显示TBI后血浆sEVs中的A2M蛋白升高,而这一蛋白是神经元损伤的指标蛋白,提示这些sEVs可能来自受损的神经元。通过研究颅脑损伤动物模型和细胞实验结果,发现受损的海马神经元释放出的sEVs富含上述促成骨功能的miRNA。研究团队意外发现TBI后sEVs在体内通过循环系统到达并在骨中富集。sEVs为何会向骨中富集?他们推测可能是sEVs膜表面的蛋白种类或数量发生了改变,使sEVs对不同器官的亲和性发生了变化。蛋白组学分析显示TBI后血浆sEVs的膜表面蛋白 FN升高,推测这一分子的变化介导了sEVs亲和性的变化,而应用FN蛋白的小分子抑制剂可抑制颅脑损伤外泌体在骨组织内的富集。可见,TBI后受损的海马神经元释放出的sEVs膜表面蛋白的改变使其在骨内富集,进而促进骨愈合。
综上所述,该研究通过系统研究揭示了在颅脑损伤情况下脑对骨愈合的调控机制:损伤的神经细胞通过释放外泌体,后者富集了促骨形成的miRNA并靶向成骨前体细胞,从而促进骨形成。
全文链接:https://www.nature.com/articles/s41467-021-26302-y