

近日,南方医科大学基础医学院李专课题组在Nature Communications(一区,IF 16.6)上,发表了题为“Autophagy regulates the maturation of hematopoietic precursors in the embryo“的研究论文。
该研究深入认识了Pre-HSC成熟的精准调控机制,为HSC体外再生的研究提供了重要的理论依据。
造血干细胞(Hematopoietic stem cell, HSC)处于造血谱系的顶端,具有自我更新和多谱系分化能力,能贡献整个生命体的血液系统。胚胎主动脉-性腺-中肾(Aorta-gonad-mesonephros,AGM)区的主动脉内皮细胞通过内皮造血转化(Endothelial to hematopoietic transition,EHT)过程,经历I 型Pre-HSC和II 型Pre-HSC阶段成熟为功能性HSC。虽然HSC发育的调控已有不少报道,但因细胞数量稀少、识别分子的动态变化等特征,Pre-HSC成熟的调控机制尚未完全理解。
细胞自噬(Autophagy)指细胞通过分解代谢过程中的货物来维持细胞稳态,以消除错误蛋白质或受损细胞器并满足细胞对能量的需求,是真核生物中高度保守的细胞内降解途径,涉及多种生物学过程。细胞自噬在成体造血中参与HSC功能的维持和分化,在胚胎阶段调控胚胎肝脏HSC的功能。然而,细胞自噬对肝前阶段胚胎AGM区Pre-HSC成熟的调控作用尚无报道。

研究团队利用自噬报告小鼠模型和条件基因敲除小鼠模型,结合单细胞转录组测序分析和体内外功能实验,揭示EHT过程中不同阶段细胞自噬状态的异质性且自噬状态与造血潜能紧密相连;并发现细胞自噬作为Pre-HSC成熟的关键调控因子;自噬这种调控作用是通过介导细胞内核仁素(Nucleolin,Ncl)的分布来实现的。此项研究揭示了细胞自噬在HSC产生过程中的生理作用,为HSC再生的阶段性调控提供了重要的理论支撑。
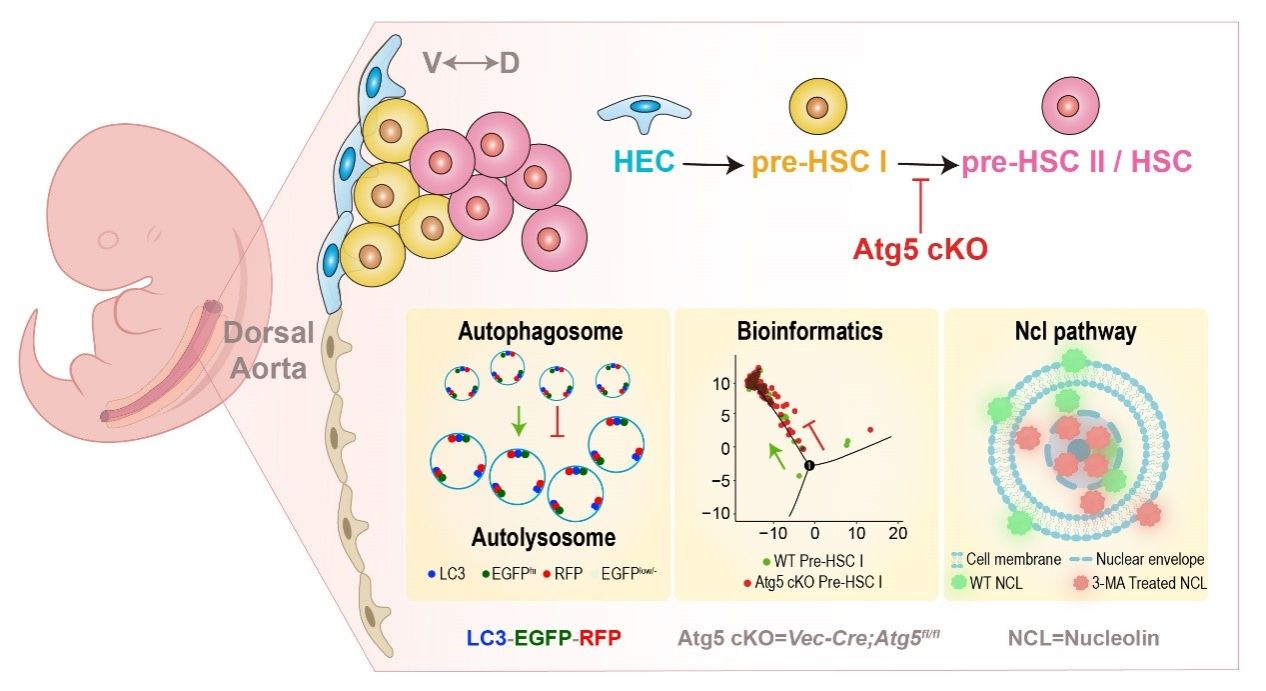
附图 细胞自噬调控Pre-HSC成熟的分子机制示意图
南方医科大学基础医学院李专教授为本文通讯作者,博士研究生刘玉敏、史林娟、硕士研究生陈一帆、博士研究生罗思凡、硕士研究生陈悦航为共同第一作者。