

近日,基础医学院周爱冬课题组联合多个团队在J Clin Invest上,在线发表了题为“TRAF3 Loss Protects Glioblastoma Cells from Lipid Peroxidation and Immune Elimination via Dysregulated Lipid Metabolism”的研究论文。研究发现:GBM中TRAF3缺失诱导的多不饱和脂肪酸(PUFA)代谢,能抑制细胞内PUFA积累和脂肪酸过氧化,并导致GBM细胞对CD8+ T细胞不敏感和免疫治疗抵抗。
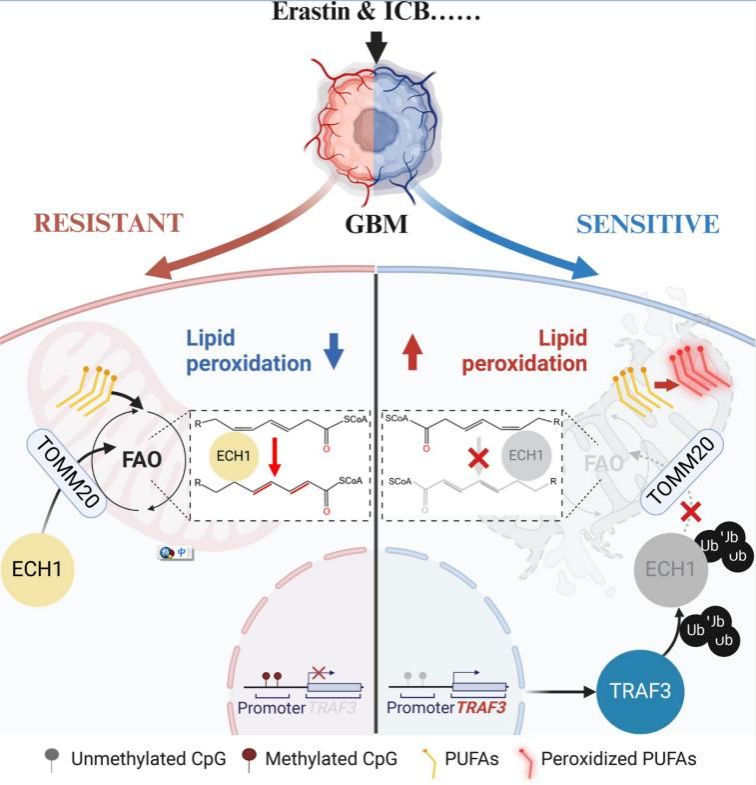
该研究对TRAF家族所有成员进行了泛癌表达分析,发现TRAF3是唯一与肿瘤良好预后相关的成员,且在胶质瘤中具有特异性。以往研究显示TRAF3特异表达于髓系和淋巴样细胞,该研究的Bulk-RNA测序和单细胞测序分析结果表明:TRAF3主要表达于肿瘤细胞,且其表达水平随肿瘤恶化程度升高而显著降低。甲基化测序分析表明TRAF3启动子的高度甲基化是TRAF3在GBM中下调表达的主要原因。该研究通过蛋白质谱鉴定TRAF3能与烯酰辅酶A水合酶ECH1相互作用,TRAF3介导ECH1 K63依赖的泛素化,从而抑制ECH1的线粒体转位。与饱和脂肪酸(SFA)直接进入线粒体进行β-氧化不同,PUFA需要先进行不饱和键的变构才能进行β-氧化。ECH1作为催化3,5-二烯酰基-CoA异构化为2,4-二烯酰基-CoA的关键酶,对于PUFA异构及后续有效的β-氧化至关重要。该研究发现,GBM中TRAF3缺失能诱导ECH1的线粒体转位,促进PUFA β-氧化,从而避免PUFA 积累导致的脂肪酸过氧化和线粒体损伤。
由于PUFA积累导致的脂肪酸过氧化是铁死亡以及由此介导的CD8+ T细胞肿瘤杀伤的重要原因,该研究发现回复TRAF3能有效提高铁死亡诱导剂对GBM细胞的杀伤作用,并显著增强PD-L1 mAb在GBM中免疫治疗的效果。因此,靶向TRAF3-ECH1通路介导的PUFA代谢联合免疫治疗是GBM重要的潜在治疗策略。
南方医科大学基础医学院博士后曾宇、硕士生赵李倩、博士生曾坤林为论文共同第一作者,基础医学院周爱冬、白晓春和邓凡,以及广州医科大学附属妇儿医院宋烨为共同通讯作者。