基础医学院邓凡团队在Drug Resistance Updates发表去势抵抗性前列腺癌恩杂鲁胺耐药的最新研究成果
近日,基础医学院邓凡团队在国际期刊Drug Resistance Updates(1区Top期刊)上刊发了题为 “Inhibition of phosphoglycerate dehydrogenase induces ferroptosis and overcomes enzalutamide resistance in castration-resistant prostate cancer cells”的研究论文。
去势抵抗性前列腺癌(CRPC)是导致前列腺癌病人死亡的最主要原因。尽管以恩杂鲁胺(enzalutamide)为代表的第二代靶向雄激素受体疗法已经成功用于CRPC治疗,然而,几乎所有接受治疗的患者都会产生耐药性,最终导致死亡。过往对于CRPC的恩杂鲁胺耐药分子机制多聚焦于 AR信号激活、表观遗传与谱系可塑性改变及PTEN缺失导致的PI3K-AKT-mTOR信号异常激活等。然而,肿瘤的营养代谢的重编程,尤其是氨基酸代谢调节在CRPC恩杂鲁胺耐药中的功能作用及分子机制尚不清楚。
在国家自然科学基金课题资助下,研究团队发现,丝氨酸生物合成途径(SSP)的关键限速酶--磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase, PHGDH)在包括前列腺癌在内的多种肿瘤中异常高表达,且与CRPC的恩杂鲁胺药物抵抗性密切相关。进一步体内外实验表明,敲低PHGDH或抑制其活性均能有效抑制恩杂鲁胺抵抗的CRPC细胞生长、诱导铁死亡,并能抑制体内成瘤及克服恩杂鲁胺的耐药性;此外,PHGDH特异性抑制剂NCT-503与恩杂鲁胺联用可有效抑制体内异种移植的CRPC肿瘤的生长。机制上,PHGDH可通过抑制p53信号通路,促进GSH/GSSG水平及铁死亡相关蛋白SLC7A11的表达,并抑制LipROS的产生,最终抵制肿瘤细胞铁死亡。该研究从调控CRPC肿瘤铁死亡角度揭示了PHGDH引起的CRPC肿瘤恩杂鲁胺耐药的新的分子机制,为CRPC患者的治疗提供了新的潜在治疗靶点,具有重要的理论和临床价值。
基础医学院细胞生物学王金祥博士,中山大学第七附属医院曾乐立副教授为本文并列第一作者;细胞生物学教研室邓凡教授(最后通讯作者)、南方医科大学第五附属医院曾方银教授,中山大学第七附属医院潘逸航教授为本文的共同通讯作者。
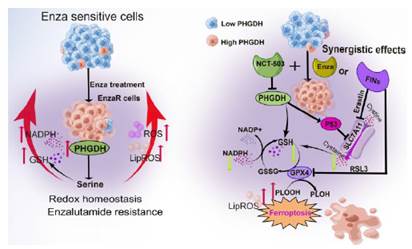
PHGDH在CRPC前列腺癌恩杂鲁胺耐药中的铁死亡抵抗效应及其作用机制模式图
