

一氧化碳(CO)和一氧化氮(NO)等气体分子在癌症治疗中展现出潜力,但临床应用面临巨大挑战。气体分子反应性强、半衰期短;传统人工合成的气体供体存在化学稳定性差、制备复杂的问题;气体在体内(尤其是健康组织中)容易发生非特异性释放,导致潜在毒性;肿瘤微环境特点(如过氧化物酶活性有限)也限制了NO的治疗效果。因此,亟需开发安全、精准、高效的靶向气体递送系统。
输血,常用于补充失血或治疗贫血,其核心成分——红细胞(RBC)不仅是高效的氧气运输工,还拥有结合一氧化碳(CO)和一氧化氮(NO)等治疗性气体的潜力。这使得红细胞有望成为新型“气体载体”,解决传统气体疗法在体内非特异性释放和不稳定的难题。基于此,南方医科大学药学院周东方教授团队近期在Advanced Materials期刊上发表了“Engineering Red Blood Cells for Amplified Tumor Dual-Gas Transfusion Therapy”的研究工作,通过对红细胞进行工程化改造,开发出一种可用于肿瘤双气体输注治疗的新策略。

该研究通过对红细胞进行三重工程化改造(纳米化工程化、气体工程化、肿瘤膜工程化),构建出可精准靶向肿瘤的“智能气体载体”。首先,将红细胞尺寸缩小为纳米级(nRBC),使其能有效穿透血管壁,浸润肿瘤组织。其次,分别让纳米红细胞负载CO(形成nRBCCO)或NO(形成nRBCNO),再将两者结合(nRBCCO/nRBCNO),实现CO和NO双气体共递送。最后,为提升靶向性,研究还整合了肿瘤细胞膜包裹技术,使工程化红细胞能精准识别并归巢至同源肿瘤细胞,实现个性化治疗。该纳米递送平台的核心“智能”在于:工程化红细胞能特异性响应肿瘤细胞内高水平的过氧化氢(H2O2),在肿瘤部位精准释放气体。释放的CO和NO在红细胞内的亚铁血红蛋白(HbFe²⁺)催化下发生协同反应,级联产生大量强效的活性氧(ROS)和活性氮(RNS,如过氧亚硝酸盐ONOO⁻),形成强大的“气体炸弹”效应。同时,产生的RNS不可逆损伤代谢酶,扰乱肿瘤细胞糖代谢,切断其能量供应,有效逆转肿瘤免疫抑制微环境,将“冷”肿瘤转化为“热”肿瘤,激活抗肿瘤免疫反应。进一步与免疫检查点抑制剂(如αPD-L1抗体)联用,在抑制转移性肿瘤方面展现出强大的协同作用。
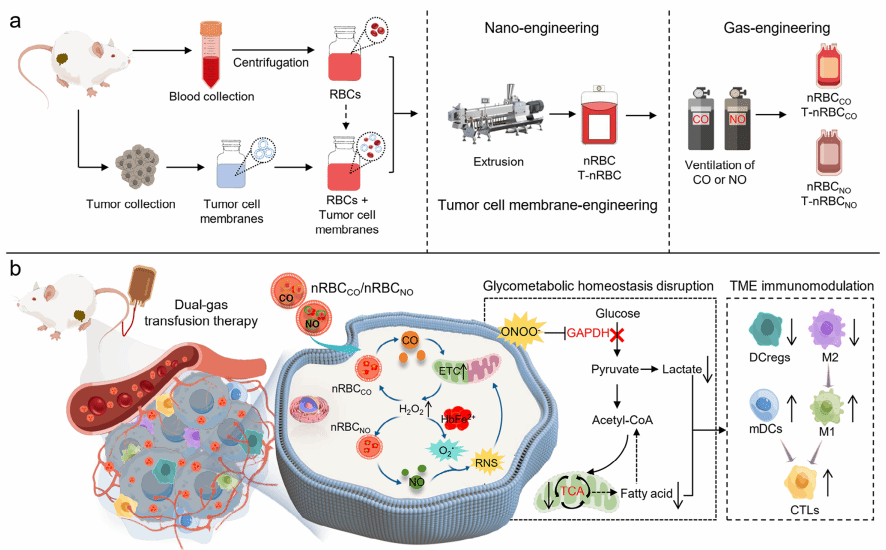
综上所述,该研究创新性地将临床常规红细胞输注疗法通过简单的工程化技术拓展到为肿瘤精准气体输注疗法,有望为癌症治疗提供新范式,极具临床转化前景。
药学院2023级硕士生李滔为该论文第一作者,且该工作获得国家自然科学基金、国家重点研发计划和广东省自然科学基金等项目资助。
原文链接:https://doi.org/10.1002/adma.202503206