

晚期肝病患者常表现出肝祖细胞(HPCs)数量与疾病严重程度呈正相关。然而,这些激活的HPCs在患者体内分化为功能性肝细胞的效率极低,导致肝脏自我修复能力受限,成为制约肝损伤后再生修复的关键瓶颈。此外,重症肝病往往伴随肠、肾、脑等多器官损伤,但目前这些器官间的互作机制及其对疾病进展的影响仍不明确。深入研究多器官间的调控关系,不仅有助于揭示肝病全身性并发症的发生机制,还可能为多靶点联合治疗提供理论依据。目前,HPCs定向分化为成熟肝细胞的分子调控机制尚未完全阐明,深入解析肝祖细胞分化的关键调控机制,不仅对理解肝脏再生修复的生物学基础至关重要,还可能为开发新型肝损伤修复疗法提供重要靶点,具有重要的科学意义和临床转化价值。
香港中文大学(深圳)附二院的彭青、南方医科大学药学院毕惠嫦、南方医科大学珠江医院张超、香港中文大学(深圳)附二院周树勤团队设计并构建了一种高度仿生的肠-肝芯片,建立了人肠上皮细胞系Caco-2/肝祖细胞系HepaRG、以及人小肠类器官/肝类器官共培养模型,系统评价其代谢能力等生物学功能,并基于该模型进一步研究了肠上皮细胞及其外泌体对HPCs肝向分化的影响。研究发现,肠上皮细胞的外泌体能够改善小鼠肝纤维化。此外,外泌体中的miR-371-373簇可能通过调节HPCs的肝分化来介导这一作用。相关结果以题为“Exosomes from intestinal epithelial cells promote hepatic differentiation of liver progenitor cells in gut-liver-on-a-chip models”的研究论文发表在Advanced Science上。
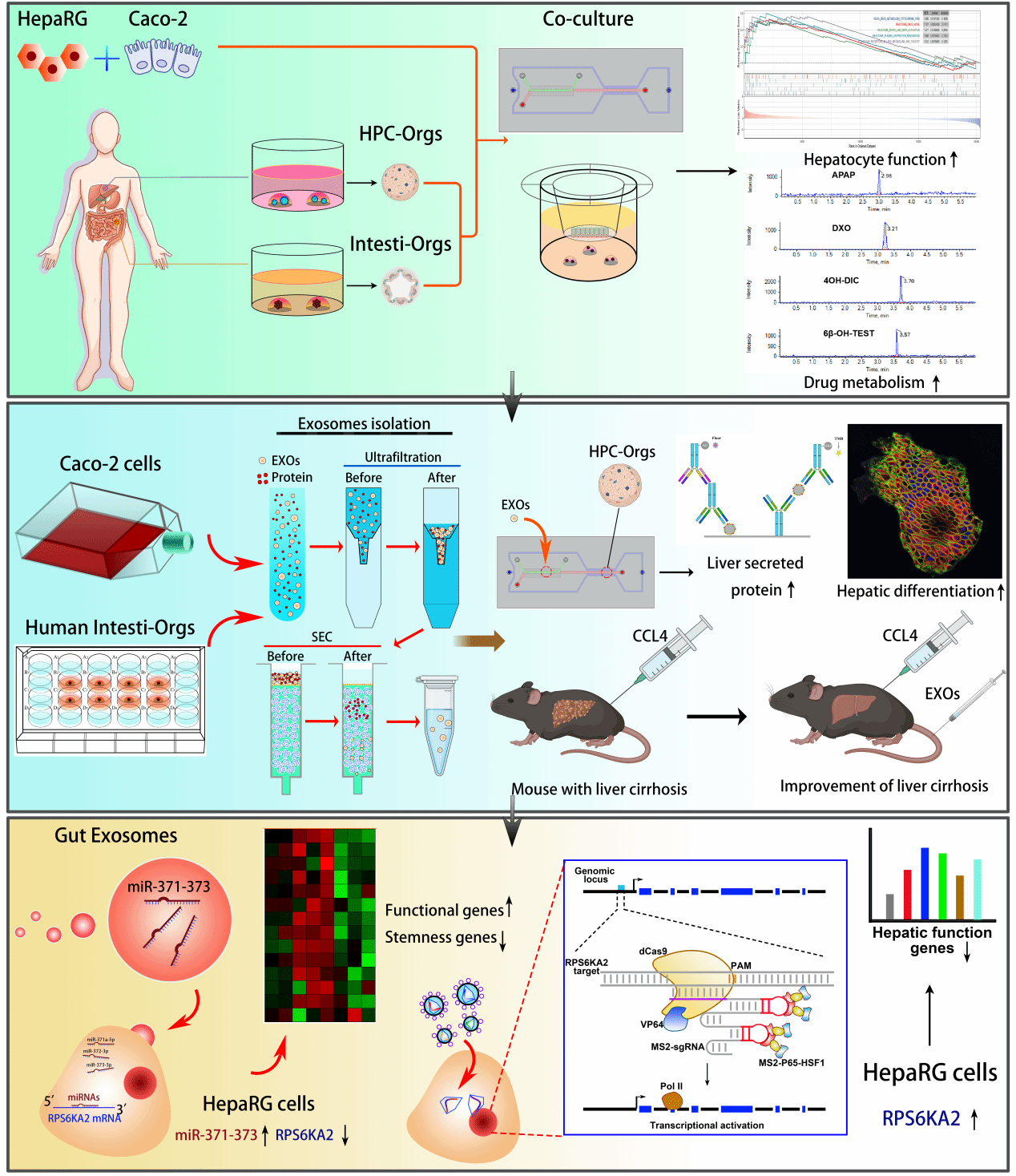
肠-肝芯片模型结果显示,肠上皮细胞通过其外泌体促进HPCs的分化。使用肠类器官衍生的外泌体治疗,显著改善了CCL4诱导的小鼠肝纤维化。这可能是因为肠上皮细胞来源的外泌体中miR-371-373簇-RPS6KA2信号通路的作用。以上研究成果可能为临床晚期肝病提供新的治疗策略。
上述工作获得国家自然科学基金、国家重点研发计划重大专项等多项经费资助。彭青、毕惠嫦、张超、周树勤为论文的共同通讯作者,研究生叶亮、李诗、毕国放及李彬辉为论文的共同第一作者。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/advs.202417478
论文信息:
Liang Ye, Shi Li, Guofang Bi, Binghui Li, Zhai Cai, Meixian Jin, Ying Zhang, Wanren Yang, Yang Li, Shao Li, Wei Hu, Yi Gao, Mingxin Pan, Shuqin Zhou*, Chao Zhang*, Huichang Bi*, Qing Peng*. Exosomes from intestinal epithelial cells promote hepatic differentiation of liver progenitor cells in gut-liver-on-a-chip models. Advanced Science, June 2025. DOI: 10.1002/advs.202417478.