

近日,基础医学院免疫学教研室余潇团队在Journal of Advanced Research(1区,IF=11.4)上,发表了题为“Dual Nature of Type I Interferon Responses and Feedback Regulations by SOCS1 Dictate Malaria Mortality”的研究论文。
疟疾(Malaria)是由疟原虫感染的传染性疾病,是全球关注的重要公共卫生问题之一。据世界卫生组织数据统计,疟疾每年感染约2.5亿人,并导致约60万人死亡。由于疟原虫种属多样性和生命周期的复杂性,既往研究对于宿主抵抗疟原虫感染免疫应答的认识不足,严重阻碍了高效疟疾疫苗的研发。因此,了解宿主在抵抗不同疟原虫株免疫应答的异同,以及疟原虫感染后宿主固有免疫信号通路的激活对疟疾发生发展的调节机制,对于研发新一代疟疾疫苗具有十分重要的科学意义。
团队前期研究发现:不同种属的疟原虫感染后产生的I型干扰素(IFN-I,IFN-α/β)在抗疟疾免疫应答中发挥双重功能。感染早期诱导的IFN-α/β反应增强抗疟疾免疫,而感染后期产生的IFN-α/β反应抑制宿主抗疟疾免疫,因此阐明疟疾感染各阶段的IFN-α/β反应动力学变化将帮助我们通过扰动IFN-I通路促进宿主抗疟疾固有免疫应答。团队通过对比不同种属的疟原虫感染,发现在Py17XL虫株感染后,TLR7-IRF7通路介导IFN-α/β的早期产生,并通过诱导CD11ahiCD49dhiCD4+ T细胞以增强抗疟疾免疫应答;相反,PbANKA虫株感染后通过TLR9-IRF7和STING-IRF3信号通路诱导的晚期IFN-α/β反应抑制疟疾抗原特异性CD4+ T细胞的产生,但促进PD-1+CD8+ T细胞从而抑制宿主抗疟疾免疫反应。
进一步研究中,团队揭示SOCS1是决定不同虫株感染后IFN-α/β产生时序差异的关键调控因子。团队通过构建数学模型,模拟分析发现SOCS1通过负反馈(negative feedback)和非相干前馈回路(I1-FFL)分别抑制IFN-α/β的持续生成和快速应答,并且各种转录因子(TFs)的差异性激活模式协同调节不同虫株感染后的IFN-α/β反应。综上,本研究揭示了IFN-I在抗疟疾免疫应答中的双重功能及其调控机制,为疟疾及IFN-I相关疾病的治疗提供了新策略。
余潇教授与青海大学蔡春梅教授为本文共同通讯作者,南方医科大学第五附属医院博士后卢键森、基础医学院博士生胡志强、基础医学院/粤北人民医院博士后江华基为并列第一作者。
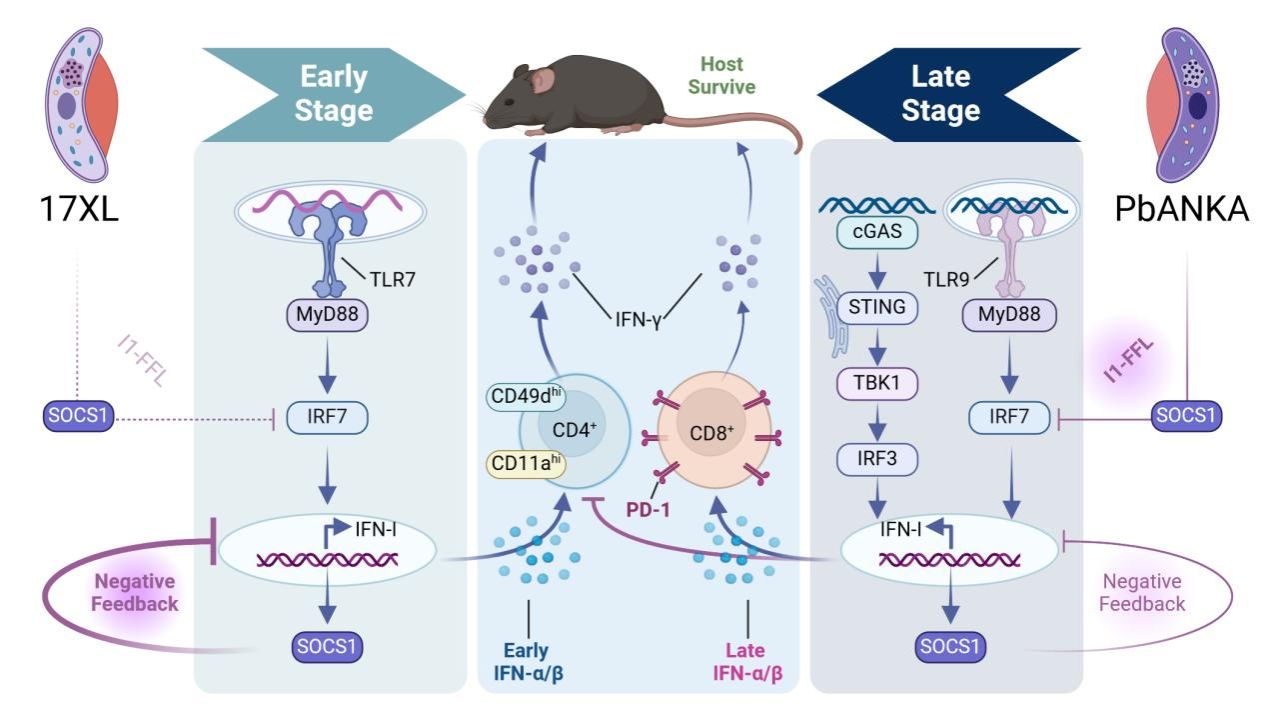
附图 I型干扰素反应的双重性和SOCS1反馈调控决定抗疟疾免疫应答的分子机制示意图
全文链接:https://www.sciencedirect.com/science/article/pii/S2090123224003709