

生物化学与分子生物学教研室毕恩广团队长期致力于实体肿瘤及血液肿瘤免疫治疗的研究,近期在T细胞亚群发现及弥漫大B淋巴瘤治疗机制方面取得新进展:一篇论文发表于PNAS(中科院一区,IF 9.4),题为“Augmenting Anti-Tumor Efficacy of Th17-Derived Th1 Cells through IFN-γ-Induced Type I Interferon Response Network via IRF7”;另一篇发表于Journal for Immunotherapy of Cancer(中科院一区,IF 10.3),题为“Bendamustine–rituximab elicits dual tumoricidal and immunomodulatory responses via cGAS–STING activation in diffuse large B-cell lymphoma”。两项研究分别针对实体肿瘤和弥漫性大B细胞淋巴瘤(DLBCL),揭示了重要的治疗机制和策略优化方向。
在实体肿瘤治疗中,当前T细胞疗法的疗效受限于T细胞耗竭和肿瘤浸润不足。研究团队发现了一种由Th17细胞衍生的Th1细胞亚群(Th171),这种细胞在抗肿瘤能力上显著优于传统的Th1和Th17细胞。具体而言,Th171细胞具有更低的耗竭状态、更强的干性和更快的迁移能力。机制上,Th171细胞的抗肿瘤效应由IFN-γ驱动,通过上调IRF7激活I型干扰素信号通路,调控其低耗竭和高迁移性。这一发现不仅深化了对Th171细胞独特作用机制的理解,也为优化T细胞疗法治疗实体肿瘤提供了新方向。
基础医学院硕士生雷小艺、临床医学八年制博士生肖锐沛和基础医学院博士生任杰等为本文共同第一作者。毕恩广教授、南方医院肾内科胡宇教授和珠江医院泌尿外科徐啊白教授为共同通讯作者。
DLBCL是成人最常见的侵袭性淋巴瘤,R-CHOP方案是目前的标准一线治疗方案,但老年患者常因合并其他疾病而无法耐,苯达莫司汀联合利妥昔单抗(BR疗法)在此类患者中表现出良好的疗效和耐受性,但其作用机制未知。本研究阐明BR疗法通过激活cGAS-STING通路诱导DLBCL发生焦亡,促使炎性因子释放,形成免疫激活的肿瘤微环境。此外,BR治疗还上调了DLBCL表面的MHC分子,增强了T细胞的激活与效应功能。该研究探讨了BR在DLBCL治疗中的独特作用机制,为优化和个性化治疗方案提供了新的见解。
临床医学八年制博士生肖锐沛,基础医学院博士生赵文丽和硕士生林伟为本文共同第一作者。南方医院蒋玲教授、基础医学院毕恩广教授和孟伟高级实验师为共同通讯作者。
|
PNAS图 Th171细胞分化调控机制
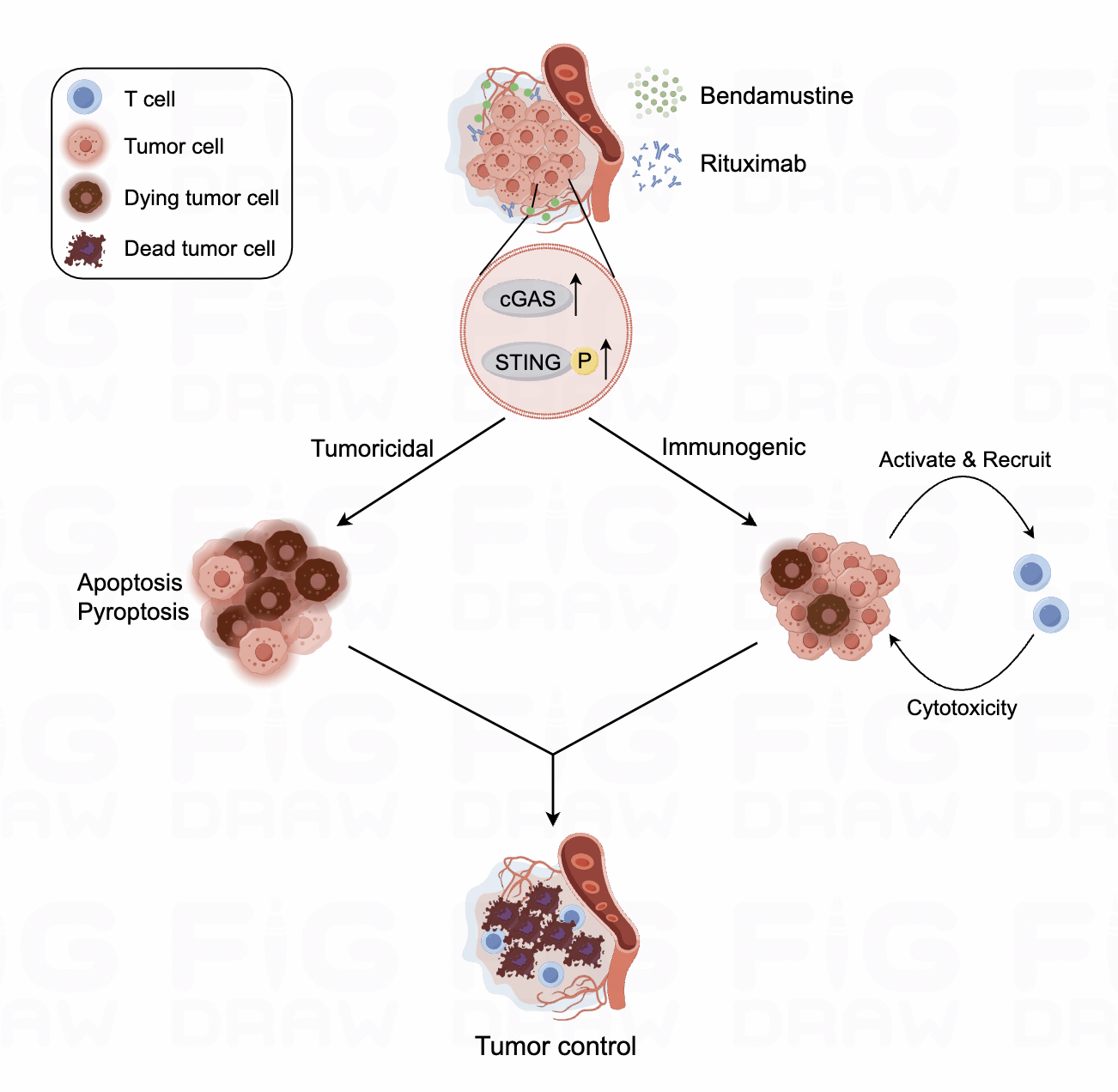
JITC图 BR治疗DLBCL的机制