

近日,荣知立、赵小阳、林瑛团队在Genome Biology(影响因子17.960,中科院小类分区1区)上,合作发表了题为“Engineered circular guide RNAs boost CRISPR/Cas12a- and CRISPR/Cas13d-based DNA and RNA editing ”的研究论文。
CRISPR/Cas系统是细菌和古细菌适应性免疫系统的一部分,用以抵御噬菌体的感染,目前已经被开发成一种高效的基因组编辑工具,广泛用于各种物种的DNA和RNA编辑。然而常用的线性gRNA易被体内的核酸内切酶和外切酶降解,半衰期短,严重限制CRISPR系统的编辑效率。
该研究采用先前报道的Tornado系统,在gRNA序列的两侧连接Twister核酶(Ribozyme),可以快速自剪切形成特定的末端,并被细胞内普遍存在的RNA连接酶RtcB连接,产生更稳定的环状gRNA(cgRNA),提高其在细胞内的丰度。随后Cas12a和Cas13d自剪切环状gRNA组装出更多Cas12a/gRNA和Cas13d/gRNA功能复合体,从而提高DNA和RNA编辑效率。
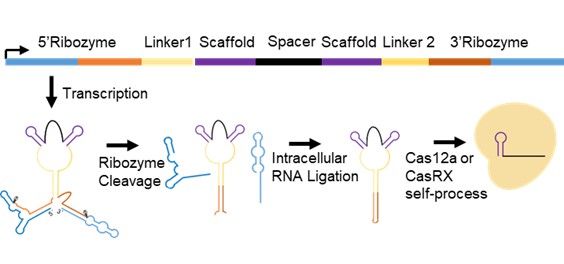
附图. gRNA环化示意图
该研究发现:在多个位点和细胞系中,cgRNA将Cas12a的激活效率提高2.1-40.2倍,且不影响其特异性,并可与p300、VPR、SunTag-VP64、SunTag-VPR等多个激活系统兼容,具有普适性。此外,cgRNA将Cas12a切割活性提高了约1.7-2.1倍,并具有高特异性。另一方面,环化gRNA提高了Cas13d的RNA编辑效率,能更有效地抑制基因表达,且不影响其特异性和侧切活性。最后,该研究将环化gRNA应用于体内,实现鼠肝脏高效的转录激活和DNA切割。
对于CRISPR系统的临床应用,体内递送通常是一个巨大的挑战,靶细胞摄取的基因编辑工具(核酸或者RNP)远小于体外或离体培养的细胞,而更稳定的cgRNA可以提高其在细胞内的丰度和持久性,在基因治疗方面具有很大的潜力。
基础医学院博士后张鑫和博士生王新龙为本文共同第一作者,荣知立教授、赵小阳教授和林瑛副教授为共同通讯作者。
全文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-023-02992-z