

近日,我校基础医学院免疫学教研室何玉梅教授团队在Allergy(中科院一区,IF 12.6) 发表了题为“Blocking the HIF-1α/glycolysis axis inhibits allergic airway inflammation by reducing ILC2 metabolism and function”的研究论文。
固有淋巴样细胞(ILC)是在肠道、肺脏、皮肤等黏膜组织富集的固有免疫细胞的一个独特亚群,尽管缺乏抗原受体表达,但ILC在表型和功能方面与常规Th1、Th2和Th17细胞具有高度同源性,因此相应地分为ILC1、ILC2和ILC3亚群。因其在宿主防御、组织重塑和修复、炎症和代谢稳态中发挥重要作用而受到广泛关注。近年来,何玉梅教授团队一直致力于ILC在肠道/肺脏炎症调控机制研究领域的探索,相应研究成果已相继发表在Communications Biology (OLFM4 modulates intestinal inflammation by promoting IL-22+ILC3 in the gut) 和Cell Death & Disease (GPX4 restricts ferroptosis of NKp46+ILC3s to control intestinal inflammation) 上。这是该团队今年继发表ILC3与肠炎调控系列研究后,针对ILC2在过敏性气道炎症调控研究领域的又一重要发现。
本研究通过临床样本及小鼠模型,从组学分析、细胞能量代谢和分子机制等不同层面阐述了HIF-1α参与ILC2代谢,从而在过敏性气道炎症调控中发挥关键作用。研究首先发现IL-33诱导的气道炎症小鼠肺来源ILC2中糖酵解相关基因,尤其是HIF-1α,显著上调;而糖酵解抑制剂2-DG或HIF-1α抑制剂2-ME可显著抑制气道炎症,伴随ILC2功能下降。进一步发现HIF-1α的条件性敲除小鼠在IL-33或HDM诱导的气道炎症模型下表现出ILC2功能抑制和气道炎症减轻,同时肺ILC2糖酵解明显受损。机制层面,染色质免疫沉淀结果证实了条件性HIF-1α敲除小鼠和2-DG处理的小鼠肺ILC2中糖酵解相关基因的转录显著下调。最后通过临床样本阐明其与疾病发生的相关性。该研究首次揭示了HIF-1α/糖酵解轴调节ILC2功能的重要性,研究结果可作为治疗过敏性气道炎症的潜在靶点,具有重要的理论和临床价值。
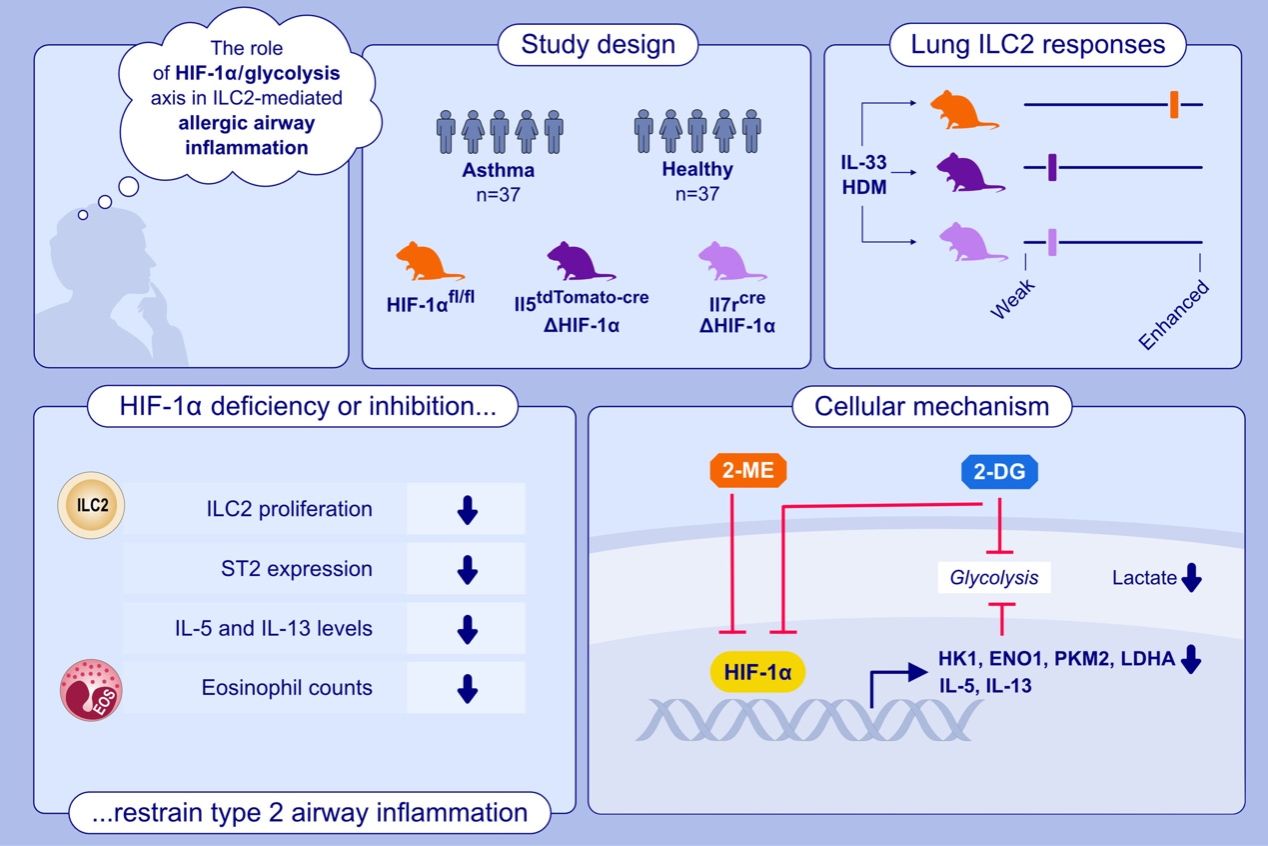
附图 HIF-1α/糖酵解轴在ILC2介导的过敏性气道炎症调控中的作用
基础医学院博士研究生张逍港,第三附属医院刘京平,基础医学院博士研究生李欣遥,广东省人民医院郑贵浪为本文共同第一作者;基础医学院何玉梅,广东省人民医院郭予雄、赵志斌为共同通讯作者。